首度出海却意外折戟,中国创新药企国际化路在何方?
国内市场竞争的日趋激烈迫使越来越多的中国制药企业将眼光投向了海外市场。
“随着创新愈发前沿、更多企业追求First-in-class全球首创,新药研发的风险也会越来越大,此时,海外市场的开发就变得特别重要。海外市场能给予企业较大的研发回报,从而支持新的研发,这于企业的长远发展非常必要。”在近日举行的2021中国医药创新100峰会上,恒瑞医药全球研发总裁张连山如此谈到药企“出海”的意义。
然而,出海并非易事。
4月9日晚,康弘药业一纸公告,宣布停止康柏西普眼用注射液全球多中心临床试验。至此,中国首个原创生物新药拓展全球市场的艰难远征正式告败,引发业界关注。
受该利空消息影响,康弘药业12日、13日已经连续两个交易日跌停。而如果从3月28日晚公司首度公告该海外临床遇挫,其法国地区的临床试验被当地监管部门拉停算起,迄今康弘药业股价已从当时的36.77元/股缩水超3成。
01
国产原创生物新药首度出海
康柏西普眼用注射液,商品名朗沐,由康弘药业子公司康弘生物研发,是新一代抗VEGF融合蛋白。
抗VEGF药物是新生血管性眼底病的主流疗法,目前国内市场上共有三款相关产品,除了康弘药业的康柏西普以外,还有诺华的雷珠单抗以及再生元的阿柏西普。
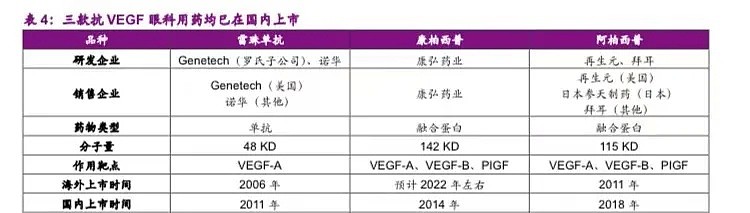
图|来源:光大证券研报
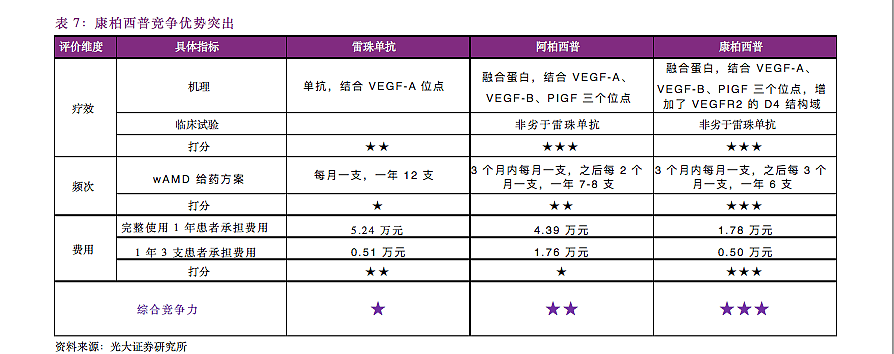
综合比较疗效、频次、费用三方面的指标,康柏西普的实力并不弱于两款进口产品。以注射频次为例,雷珠单抗需每月注射一支(一年共计12支),阿柏西普说明书推荐的给药方案是核心3针后每2月1针(一年7-8支),康柏西普则是核心3针后每3个月1针(一年6支),更低的注射频次也意味着更高的患者依从性和更低的治疗负担。
康柏西普湿性年龄相关性黄斑变性(wAMD)适应症于2013年11月获国家药监局批准上市,2017年获批新适应症病理性近视(PM)继发的脉络膜新生血管(pmCNV)引起的视力下降,2019年新增糖尿病性黄斑水肿(DME)适应症。
此外,在今年1月,康柏西普第四个适应症—视网膜静脉阻塞(RVO)也递交了国内上市申请。
据康弘药业财报,康柏西普自上市后销售额逐年攀升,2019年康柏西普销售额11.55亿元,上市以来累计销售额超过40亿元。2015年至2019年其收入占比攀升至35.5%,净利润占比攀升至50.7%,成为康弘药业的当家品种。另据米内网数据,近年来康柏西普眼用注射液在我国公立医疗机构终端眼科用药市场中的份额不断增加,从2015年的3.77%到2019年突破10%,2020年上半年再创新高,跃升到第二位,仅次于诺华的雷珠单抗注射液。
或许是实力带来的“底气”,加上受海外更广阔市场空间的吸引(2020年,阿柏西普Eylea销售额高达79亿美元,位列全球畅销药第8位),康弘药业也有了将康柏西普推向国际的想法。
国内上市3年后,2016年10月,康弘生物获美国FDA准许,直接在美国开展康柏西普眼用注射液治疗wAMD适应症III期临床试验。
随后,在2017年11月,康弘生物与美国CRO公司INC Research(后更名为Syneos Health)及其母公司INC Research Holdings Inc.签署了临床试验研究相关服务协议,聘请INC Research为康柏西普的海外临床实验提供外包服务。
接着,康弘生物与国内外知名专家共同制定了康柏西普wAMD适应症的与阿柏西普头对头比较的国际多中心III期临床方案。
整个国际多中心临床研究计划(简称“PANDA试验”)在全球30多个国家和地区的300多个临床试验中心开展,包括两个独立、相似的试验(KH-1801和KH-1802),每个试验计划入组约1140名受试者,以1:1:1的比例分组接受0.5mg康柏西普、1.0mg康柏西普和2.0mg阿柏西普的玻璃体腔注射。研究的主要目标是明确每2月注射一次0.5mg康柏西普或每3月注射一次1.0mg康柏西普的疗效是否非劣效于每2月注射一次2.0mg阿柏西普的疗效。评估方式为采用ETDRS方法来评估第36周最佳矫正视力(BCVA)较基线的变化,主要终点是受试眼第36周ETDRS BCVA字符数得分较基线的平均变化。
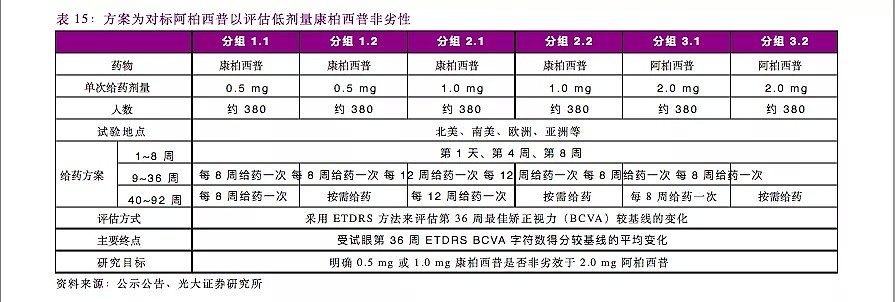
2018年4月,该临床方案获美国FDA审核通过。
2018年5月,康弘生物正式在欧美开展国际多中心III期临床试验。
事实上,康柏西普上市初期,正处国内原创新药匮乏的年代,而康柏西普绝对算得上是当时的佼佼者,也因此,不仅是康弘药业对其出海远征寄予了厚望,不少局外人同样期待康柏西普与阿柏西普头对头PK的结果,北控医疗产业基金投资总监段铮便是其中之一。
而当康柏西普全球多中心临床爆出失败的惊雷之后,他深感意外和惋惜,“这对于正尝试走出去的中国制药行业来说,是一个打击。”他认为。
与此同时,对于市场中因康柏西普海外临床失败而质疑其国内疗效数据的一些声音,他则认为,“情况并没有那么悲观”。
“康柏西普由荣昌生物创始人房健民博士以及信达生物的俞德超博士联合开发,房、俞两人的实力业界有目共睹,我个人认为康柏西普作为两人早期创业选择的品种和方向,他们对此肯定是有较大把握。”段铮告诉华尔街见闻。
如段铮所预期的一样,在11日由浙商证券组织的“康柏西普全球多中心临床实验停止情况说明会”上,康弘药业管理层更是给出了康柏西普疗效无容置疑的回应。
据公司所称,自康柏西普2013年国内获批上市之后,截至2020年底,已累计注射150余万次,国内临床专家开展的与康柏西普相关的各类临床达到74项,覆盖13000多名患者,大量的临床研究以及真实世界使用经验表明,康柏西普的安全性和有效性已经得到充分验证。
02
临床失败,新冠疫情的锅?
虽然已经公告停止PANDA试验,但由于试验数据的分析与调查工作还在推进当中,因此目前康弘药业披露的信息仍有限,而实验失败的最终原因也未有盖棺定论。
不过,仅从公司9日晚公告所述来看的话,新冠疫情导致的大量受试者偏离试验规定的给药方案可能是一个比较关键的影响因素。
“(因为疫情),使得大量受试者脱落、失访、超窗,完全符合PANDA试验给药方案的病例已逐步降低到不足入组病例的40%(即40%的违反方案率)。”
“(因为疫情),国际航运和出行限制的阻碍,使得需要全程冷链配送的试验药品的质量控制以及需要去医院现场进行的临床监查和稽查,都变得格外艰难。”
康弘药业在其公告中这样表示。
但对于公司给出的“疫情影响论”,市场不买账者居多。“又不是只有你一家在海外做临床,怎么其他biotech都好好的?”有人说。
但约印医疗基金董事总经理张亮并不这么看,他对华尔街见闻表示,疫情影响下患者脱落是肯定的,如果公司想继续推进临床,则可以向监管部门申请修改临床方案,增加受试者,“但前提还需评估已有的患者脱落有多严重,会对整个临床试验的终点产生多大的影响”。
“事实上,对于中国本土药企而言,哪怕是在国内做几十个中心的临床,很多都不一定能hold住,更别提国外了。在国外开展这样一个多中心的III期大临床难度太大,要求太高。在海外,本土药企最多就是1、2期小样本量的临床。”张亮表示。
他的说法也得到了临床CRO公司昆翎医药创始人兼首席战略官张丹博士的证实。
“咱们国家的药企到海外做关键性III期、大规模多中心临床实验仍是罕见现象,我们还处于学习、理解和尝试的过程中。”张丹博士表示。
他同时指出,疫情造成的受试者脱落、失访、超窗以及违反试验规定的给药方案等情况,均有可能影响临床试验结果。
“一般来说,如果一个临床实验的违反方案率超过30%,那么该临床试验的可信度就会存疑,其结果不管是阴性还是阳性也都不再靠谱。”张丹告诉华尔街见闻。
这或许也能解释市场的一个疑问。
在康弘药业的公告中,公司表示:“高达68个试验中心中(总计300多个临床试验中心),有一半以上的受试者视力在注射后较基线变化等于甚至低于零,这与试验药物既往的临床研究以及真实世界大量的使用经验有很大差异。”
对此,市场解读认为康柏西普“无效”。不过,康弘药业管理层在11日举行的“康柏西普全球多中心临床实验停止情况说明会”上表示,该分析是基于康柏西普和阿柏西普的所有入组患者,因而仅以此来断定“康柏西普无效”系误读。
但在段铮看来,很多临床研究表明,即便是安慰剂,那也是有一定效果的,但以上分析显示,康柏西普和阿柏西普可能对不少受试者无效,“连安慰剂都不如,这的确令人费解”。
市场无法释怀的另一重疑问是,康弘药业并不是没有为此次出海下血本,与公司合作的乃是全球排名前三的CRO公司。既然有了海外专业服务方的支持,为何最终整个临床还是出现了诸如大量受试者脱落等非科学性的纰漏,将此仅归咎于疫情又是否完全合理?
对此,张丹博士对华尔街见闻解释称,临床试验申办方与CRO公司之间其实是决策者和执行者的关系,而临床方案的设计、对试验关键点的判断、组织第三方独立的安全监察委员会等工作都是申办方的责任。
由此可见,临床实验其实是一个复杂的系统工程,试验结果亦受多种因素影响,考验的不仅仅是受试药物本身的有效性和安全性,同时还有公司自身的临床试验管理能力。当然,还有企业面临不可预知情况的应对能力。
康弘药业PANDA试验的失败很容易让人想起另一家本土药企的海外远征。在此之前,天士力的中药独家产品复方丹参滴丸是全球首例在海外研发并完成Ⅲ期临床研究的复方中药。
其Ⅲ期临床试验研究自2012年8月正式开始,在美国、加拿大、俄罗斯、乌克兰、格鲁吉亚、白俄罗斯、墨西哥、巴西及台湾9个国家/地区的127个临床中心展开。
虽然这一Ⅲ期临床试验已于2016年3月结束,而在当年12月,天士力也公告了复方丹参滴丸美国FDA国际多中心III期临床试验结果,但由于复方丹参滴丸一直未能在美国上市,因此有市场推测认为该Ⅲ期临床试验或已经失败。
而据业内传闻,与康弘药业类似,复方丹参滴丸海外多中心Ⅲ期临床试验也曾遇到因部分受试者偏离试验规定的给药方案,最终导致符合试验给药方案的病例数不足的情况。
这难道只是巧合?
虽然落败,但作为较早试水出海的先行者,康柏西普的经历与经验对于业界其他同行来说极具借鉴参考价值,同时也激起各方思考。比如国内某头部药企的研发总裁便对华尔街见闻表示,风险永远存在,事在如何管理。临床设计、方案、运作都很重要。出海的项目一定要经过严格的科学流程,有自己的思想,毕竟是自己的产品,自己心里应该有数。
昆翎医药的张丹博士作为临床研究的资深专家,他对出海企业给出的建议则是,如果要去海外开展大型Ⅲ期关键性研究,那就要做更多的前期准备工作。
“譬如说,可以在西方人群中先做一个小样本的试验,如果拿中国人群的数据来推算西方人群的有效性,以及确定入组患者例数的话,肯定有猜测的因素,最好拿西方人群的小样本结论来推算大样本表现。”他说。
03
康弘研发困境:起了个大早,赶了个晚集?
对于围观群众来说,康柏西普海外临床失败带来的震惊只是一时的,但对于康弘而言,此事的影响却可能是多维的。
例如,为推进康柏西普海外上市,2020年12月,公司发布定增公告,拟向不超过35名特定对象非公开发行不超1.84亿股,募集资金总额不超过34.72亿元,将投向康柏西普眼用注射液wAMD适应症国际III期临床试验及注册上市(拟投入募集资金金额6.08亿元)、康柏西普眼用注射液RVO/DME适应症(视网膜静脉阻塞/糖尿病黄斑水肿)国际III期临床试验及注册上市(拟投入募集资金金额19.65亿元)等项目。这也是康弘药业自2015年上市以来的首次定增再融资。
现在,康柏西普wAMD适应症的国际III期临床试验已被拉停,那么其他适应症还要继续尝试海外上市吗?此次定增又该何去何从?
此外,康柏西普海外临床的失败是否会影响其国内销售?
针对这些市场疑问,康弘药业方面表示,在对PANDA试验完成进一步的调研与分析之后,公司会审慎决定康柏西普RVO/DME适应症的国际III期临床是否还会持续。同时,公司预期,PANDA试验的失败或会在短期内影响康柏西普国内销售,但基于公司已有成熟销售和学术推广队伍,加上国内大量临床研究和真实世界使用经验很好验证了康柏西普的安全性和有效性,因此“相信康柏西普的临床应用很快会重回正轨”。
不过,以上表态似乎仍不能提振市场信心,12日、13日康弘药业股价连续两个交易日封板跌停。
事实上,即便没有这一次的临床失败,市场对康弘也已有诸多指摘,正如公司董事长柯尊洪在11日的电话会议中所称的那样,“很多投资人说公司每年的年报没有新意,研发也不够...”
其实,康弘并非没有研发。目前,公司在小分子新药、合成生物平台、抗体药物、基因治疗等领域均有布局,包括治疗脑胶质瘤的项目KH617、用于眼科治疗的新靶点项目KH615、用于治疗抑郁症的KH607、用于治疗结直肠及其他器官肿瘤且拥有国际发明专利的1类生物新品KH903、用于治疗外伤、化学烧伤、角膜移植术后诱发的新生血管的KH906滴眼液等。
然而,在时间就是金钱的今天,康弘新药研发项目的推进速度总是低于预期,如KH903原计划于2019年上市,但目前还在临床2期,KH906滴眼液原计划2020年上市,目前也还在临床阶段。
而就此次风波中的康柏西普海外多中心临床来说,此前亦有投资人向华尔街见闻表示,其认为该临床的启动有些晚了,理由是“海外竞争在加剧,不仅有雷珠单抗和阿柏西普的生物类似药要上市,甚至下一代药物都要来了”。
公开信息显示,诺华Beovu(brolucizumab,RTH258)已于2019年10月获美国FDA批准上市,用于治疗湿性年龄相关性黄斑变性(wet-AMD),给药时间间隔与康柏西普一样是3个月。另外,罗氏计划于2021年提交Faricimab(RO6867461,RG7716)用于糖尿病性黄斑水肿(DME)和与年龄相关的湿性黄斑变性(wAMD)的上市申请,而这款药物最终获批的给药时间间隔可能达到4个月。
或许,也是因为这样,康弘药业才会在公告中隐晦地表示,综合考虑全球公共卫生事件尚在蔓延的复杂国际局势和不确定的外部环境等诸多风险,“继续推进PANDA试验已经无法获得具有注册价值的结果”,并最终无奈给这一次的PANDA全球试验划上了句号。





 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


