国产仿制版辉瑞新冠口服药或将问世,两项临床试验已注册(组图)
据中国临床试验注册中心网站信息,2022 年 9 月 26 日,石药集团注册了奈玛特韦片(nirmatrelvir)的相关临床试验。
注册信息显示,该试验目的旨在评价石药集团中诺药业生产的奈玛特韦片与辉瑞 Pfizer Manufacturing Deutschland GmbH 生产的参比制剂奈玛特韦片的生物等效性。
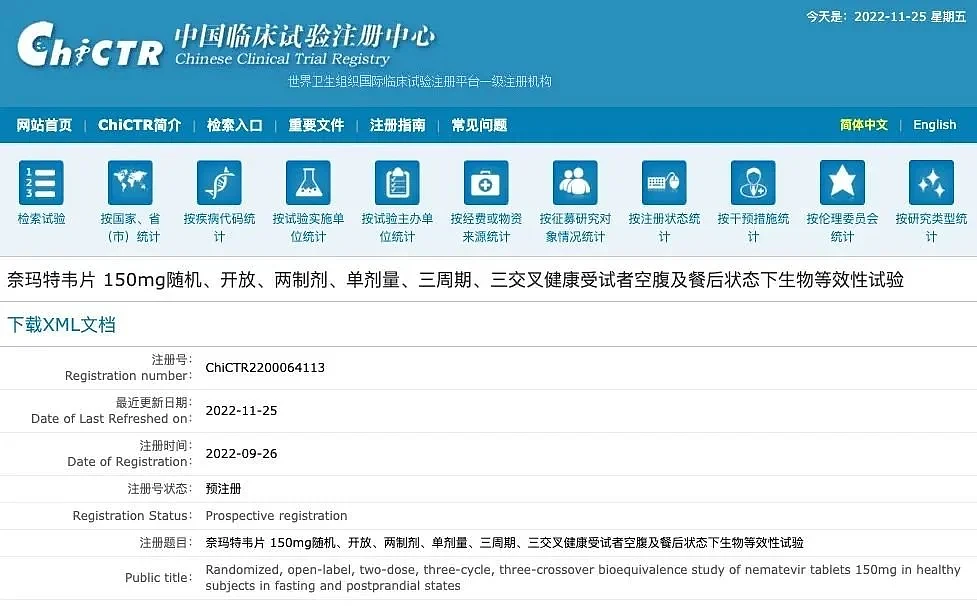
中国临床试验注册中心网站截图
所谓参比制剂(reference listed drug,RLD),指的是仿制药开发时作为被仿制对象的对照药品,一般采用境内外首个获批上市且具有完整和充分安全性、有效性数据的原研药品。
而生物等效性(bioequivalency , BE ),则是指同样试验条件下,等量仿制药和参比制剂在生物体内吸收程度和速度等指标的差异情况。如果两者差异在一定范围内,通常认为两种药物安全性、有效性相当。
奈玛特韦片为 PAXLOVID 主要成分
石药集团此次仿制奈玛特韦片,是辉瑞研发的新冠口服抗病毒药物 PAXLOVID 的主要成分之一。
PAXLOVID 包括奈玛特韦(nirmatrelvir,PF-07321332)和利托那韦(ritonavir)两部分,其中奈玛特韦是一种新冠病毒的 3CL 蛋白酶抑制剂。
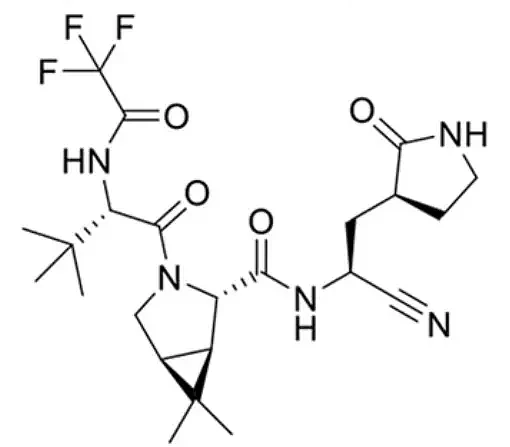
奈玛特韦分子结构 图源:参考资料
新冠病毒是蛋白质包裹的单链 RNA 病毒,在复制过程中,RNA 先会编码出 2 个大的多聚前体蛋白和 4 个结构蛋白。多聚蛋白需要经过蛋白酶水解产生短的、非结构蛋白,促进病毒复制。
在水解过程中,起到关键作用一种酶叫做 3CL 蛋白酶(也叫主蛋白酶,Mpro)。而奈玛特韦可以通过抑制 3CL 蛋白酶,从而阻止新冠病毒的复制。
奈玛特韦对病毒的抑制活性较强,在表达 ACE2 蛋白的人气道上皮细胞、HeLa 细胞和 A549 细胞中,PF-07321332 的半抑制浓度 IC50 分别为 62、99 和 56 nM。(IC50 越低,活性越强。对比来看默沙东 Molnupiravir 的 IC50 为 220 nM,吉利德 Remdesivir 则是 651 nM)
而奈玛特韦渗透性和口服吸收利用度很低,主要经 CYP3A4(细胞色素 P450 3A4 酶)代谢,因此,加入强 CYP3A4 抑制剂利托那韦后,可以有效提高奈玛特韦的治疗浓度。
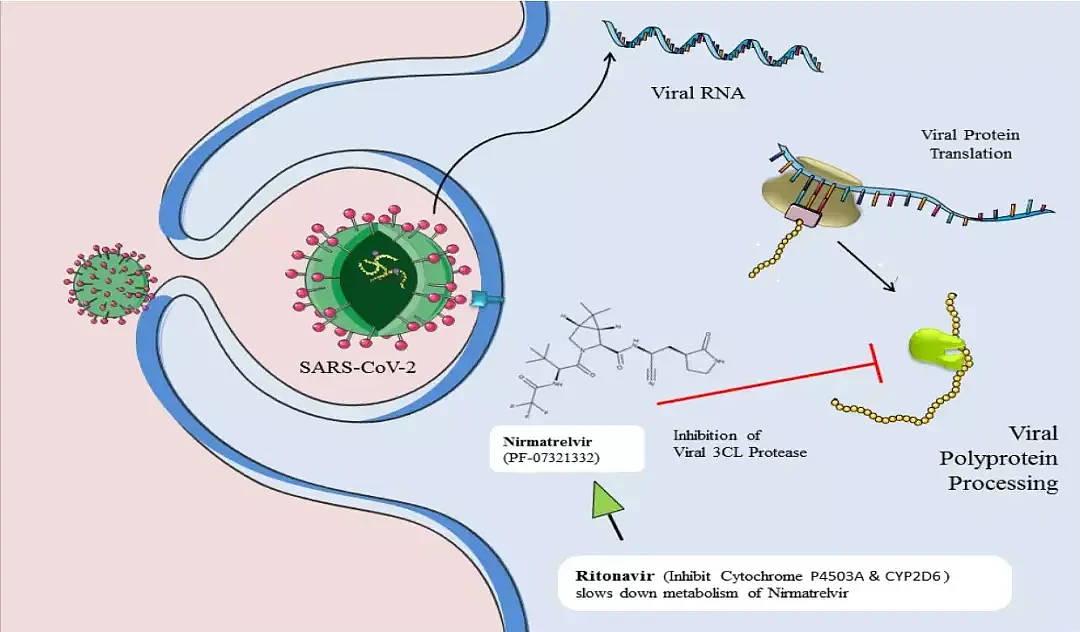
根据辉瑞披露的 II/III 期研究数据,与安慰剂相比,在症状发作后三天内接受 PAXLOVID 治疗的患者中,新冠患者的住院或死亡率降低了 89%;在症状出现后 5 天内接受 PAXLOVID 治疗的患者,住院或死亡的风险与接受安慰剂相比降低了 88%;对于 65 岁或以上患者。PAXLOVID 可将相对风险降低 94%。

图源:辉瑞官网
今年 2 月,PAXLOVID 获得国家药监局附条件批进口注册。3 月更新的新冠肺炎诊疗方案第九版中,治疗方案增加了 PF-07321332/利托那韦片(即 PAXLOVID),并纳入医保支付。

国家药监局官网截图
首个国产仿制 PAXLOVID 或将问世
3 月 17 日,日内瓦药品专利池(MPP)在其官网宣布,35 家企业已与之签署协议,可仿制生产辉瑞新冠口服药「奈玛特韦/利托那韦片」(PAXLOVID)的成分之一奈玛特韦。
这 35 家企业中有 5 家中国药企,分别为:华海药业、普洛药业、复星医药、九洲药业、上海迪赛诺。根据协议,在 WHO 认定新冠传播为国际关注的突发公共卫生事件期间,辉瑞公司将不会向这些企业收取该药的专利税。
而根据协议规定,此举是为了扩大辉瑞新冠口服药在 95 个中低收入国家的可及性,而其中并不包含中国——也就是说,上述获得仿制药生产许可的中国企业,所生产的 PAXLOVID 也不能在中国地区进行销售。
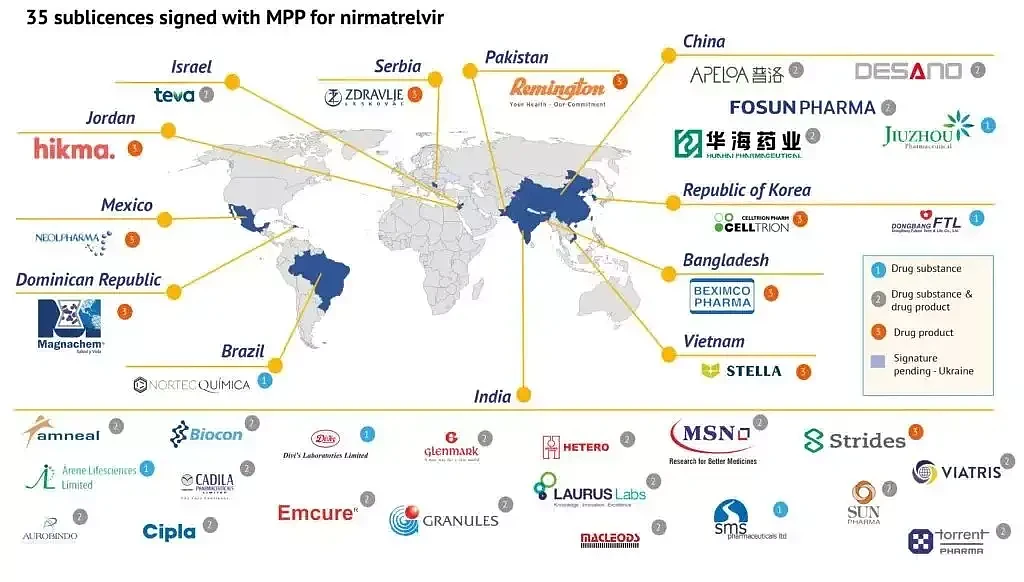
图源:MPP 官网
今年 8 月,华海药业发布公告称,已与辉瑞就新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(PAXLOVID)签署了本地化生产协议。华海药业将在协议期内(5 年)为辉瑞公司在中国大陆市场销售的新冠病毒治疗药物 PAXLOVID 提供制剂生产服务。
根据协议条款,辉瑞公司提供奈玛特韦原料药与利托那韦制剂,华海药业负责奈玛特韦制剂生产,并完成组合包装;合作范围为在中国大陆市场销售的 PAXLOVID。

华海药业官网截图
对于 PAXLOVID 的另一成分利托那韦,此前已经通过利托那韦仿制药一致性评价的歌礼药业,于今年 10 月发布公告,宣布与辉瑞就 PAXLOVID 签订利托那韦的授权和采购协议。
公告称:在有效期 5 年时间内,「将非排他性地授权辉瑞中国在中国大陆使用歌礼的利托那韦片部分注册资料用于新冠药物 PAXLOVID,并为辉瑞中国在中国大陆生产和供应利托那韦片。」
根据以上信息,目前,国产药企要么不具备在中国大陆销售 PAXLOVID 的许可,要么与原研药企合作,负责生产、组合包装,而药物核心成分奈玛特韦的原料药依然由辉瑞提供。
此次石药集团登记的奈玛特韦片相关临床试验为「奈玛特韦片 150mg 随机、开放、两制剂、单剂量、三周期、三交叉健康受试者空腹及餐后状态下生物等效性试验」。
研究于树兰(杭州)医院开展,计划实施时间为 2022/9/24~2023/4/1,招募年龄 18~59 周岁的男性和女性健康受试者,比较空腹及餐后状态下单次口服受试制剂奈玛特韦片(规格:150mg/片,石药集团中诺药业(石家庄)有限公司生产)与参比制剂奈玛特韦片(规格:150mg/片;Pfizer Manufacturing Deutschland GmbH 生产)的药代动力学数据,评价空腹及餐后状态口服两种制剂的生物等效性。
该试验注册日期为 2022 年 9 月 26 日,最后更新日期为 2022 年 11 月 25 日,研究所处阶段标注为:「其他」。

中国临床试验注册中心网站截图
除了奈玛特韦,石药集团同时还申请了 PAXLOVID 另一成分利托那韦的生物等效性试验。
根据中国临床试验注册中心网站信息显示,另一项研究为「利托那韦片 100mg 随机、开放、两周期、两交叉健康受试者空腹及餐后状态下生物等效性试验」,计划实施时间为 2022/6/15~2022/12/31,招募年龄 18~59 周岁的男性和女性健康受试者,比较空腹及餐后状态下单次口服受试制剂利托那韦片(规格:100mg/片,石药集团中诺药业(石家庄)有限公司生产)与参比制剂利托那韦片(规格:100mg/片;AbbVie Deutschland GmbH&Co.KG 生产)的药代动力学数据,评价空腹及餐后状态口服两种制剂的生物等效性。
如果石药集团的两项生物等效性试验进展顺利,首个国产「PAXLOVID」可能不久后在国内上市销售。








 +61
+61 +86
+86 +886
+886 +852
+852 +853
+853 +64
+64


